SÍNTESIS
Las diversas vias intracelulares que transducen señales corriente abajo desde los receptores de la superficie celular activados difierieren en su complejidad y en el modo como transducen las señales. LOS SEGUNDOS MENSAJEROS TRANSPORTAN SEÑALES PROVENIENTES DE MUCHOS RECEPTORES.
 |
| cAMP Activa a la peoteincinasa A (PKA) http://www.esacademic.com/ pictures/eswiki/67/CAMP.jpg |
 |
| cGMP Activa a ña proteincinasa G (PKG) y abre los cnalaes cationicos en las celulas bastones. http://www.fz-juelich.de/isb/isb-1/ datapool/page/168/cGMP%20Struktur.jpg |
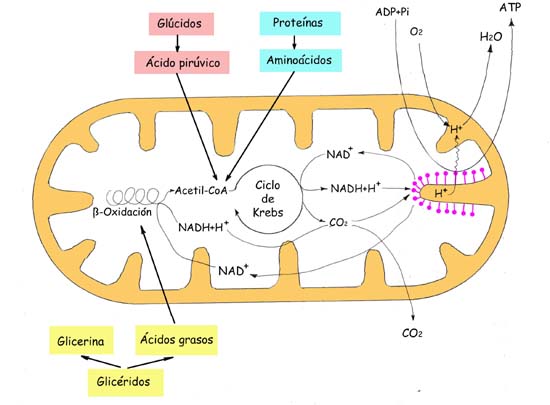
La fijacion de ligandos ("primeros mensajeros") a muchos receptores de la superficiecie celular conduce a un Aumento (o disminucion) de corta duracion en la concentracion de ciertas moleculas de señalizacion intracelular de peso molecular bajo denominados segundos mensajeros. Estas moleculas incluyeb 3', 5'-AMP ciclico (cAMP), 3'5' GMP ciclico (cGMP), 1,2- diacilglicerol (DAG) e inositol 1,4,5 - trifosfato (IP3). Otros segundos mensajeros importantes son Ca2+ y diversos inositol fosfolipidos, tambien denominados fosfoinositidos, incluidos en las membranas celulares.
La concentracion intracelular elevada de uno o mas segundos mensajeros despues de la uniion de una moleula de señailizacion externa induce una alteracion rapida en la actividad de una o mas enzimas o proteinas no enzimaticas. En el musculo, una elevacion inducida por la señal en el Ca2+ citosolico activa la contraccion; un incremento similar en el ca2+ induce la exocitosis de vesiculas secretoras en las celulas endocrinas y de vesiculas que contienen neurotransmisores en las celulas nerviosas. De manera similar una elevacion en el cAMP induce diversoso cambios en el metabolismo celular que difiere en los distintos tipos de celulas humanas.
 |
| EXOCITOSIS CELULAR Tomado de: http://upload.wikimedia.org/wikipedia/commons /thumb/1/16/Exocytosis_types.svg/400px-Exocytosis_types.svg.png |
La activacion de un tipo de receptor individual suele conducir a la produccion de multiples segundos mensajros, con efectos diferentes, Además, la misma respuesta celular puede ser inducida por la activacion de multiples vias de señalizacion. Esta interaccion de diferenres vias de señalizacion permite el ajuste de actividades celulares requeridas para llevar a cabo los complejos fisiologicos y del desarrollo.
La finalizacion rapida de la señalizacion una vez que se retira un ligando particular y la desensibilizacion del receptor con concentraciones elevadas de ligando o despues de la exposicion prolongada ayuda a las celulas a responder de manera adecuada en diferentes circunstancias.
PROPUESTA DE ENSEÑANZA
BIBLIOGRAFIA DE APOYO
YOU TUBE. Comunicacion celular [Archivo en video] [En línea] Disponible en: [http://www.youtube.com/watch?v=1fcgVYeS98g]
MARQUEZ, Silvia y otros. COMUNICACIÓN INTERCELULAR Y TRANSMISIÓN DE SEÑALES [En línea] Disponible en [http://www.genomasur.com/lecturas/Guia07.htm] [Citado en 31 de octubre de 2010]
WIKIPEDIA, La enciclopedia libre. Transduccion de la señal. [En línea] Disponible en: [http://es.wikipedia.org/wiki/Transducci%C3%B3n_de_se%C3%B1al] [Citado en 31 de octubre de 2010]
Señalizacion de la celula. [En línea] Dsponible en [http://translate.google.com.co/translate?hl=es&langpair=en7Ces&u=http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/C/CellSignaling.html] [Citado en 31 de octubre de 2010]



.jpg)